WB是检测和定量磷酸化蛋白质的重要实验方法,然而大家一直都说磷酸化蛋白WB不好做!这是因为处于不同的细胞生长状况和/或特定的细胞周期时,磷酸化蛋白可能仅占细胞总蛋白中的一小部分,处理不得当时,还会快速的去磷酸化。
磷酸化蛋白质WB做不好的原因有许多,比如封闭问题,抗体问题,或所需的磷酸化蛋白可能不存在于样品中或者低于WB检测的量。然而,有一个常被大家忽视的重要原因就是蛋白样品制备所用的方法是否适合于磷酸化蛋白的提取?
其实蛋白质提取的方法不仅影响提取效率,还会影响蛋白的质量。大家目前最常用的方法是利用溶液法进行蛋白提取(如RIPA裂解液),但是往往会在蛋白质提取中产生两个不同的组分,即RIPA可溶性和RIPA不可溶性组分。通常RIPA不可溶性组分被我们直接丢弃忽略。但是已经有文章证实许多蛋白质存在于被丢弃的RIPA不可溶性组分中 [1,2]。也就是说利用溶液法提取的并非是完整的总蛋白,而仅仅是一些可溶性蛋白。
那使用RIPA等溶液法提取的不完整总蛋白做实验,到底会不会影响我们磷酸化蛋白检测和定量研究呢?我们来一起讨论下。
1
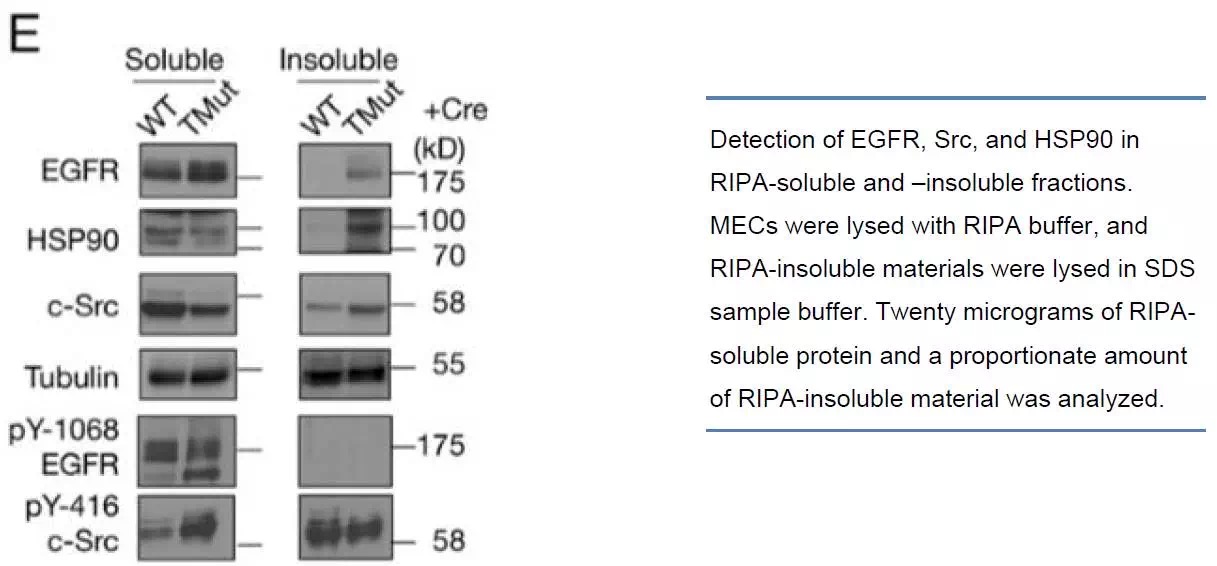
Brady等人[3]将细胞裂解物分离成RIPA可溶性和RIPA不可溶性组分,发现在两个组分中都可以检测到TDP-43的磷酸化片段。同样的,用RIPA缓冲液裂解小鼠MEC细胞时,磷酸化的EGFR(pY-1068 EGFR)只在RIPA可溶性组分中检测出。然而,磷酸化的c-Src(pY-416 c-Src)则在RIPA可溶性和RIPA不可溶组分中都能检测出, 甚至WT样品在RIPA不可溶组分中的信号比RIPA可溶性组分中更强(下图),结果表明如果仅使用RIPA可溶性组分进行实验,则磷酸化c-Src丢失[4]。就是说使用溶液法提取的蛋白谱是不完整的,蛋白有非等比例的丢失,内参也有可能存在丢失情况,那么如果做磷酸化蛋白定量,就会出现数据偏差。
2
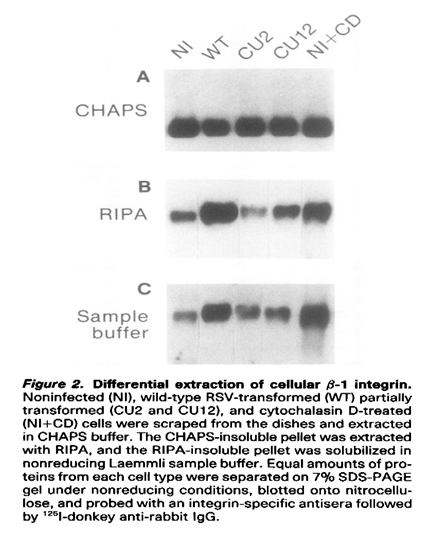
β整联蛋白是一种磷酸化蛋白,使用Chaps进行原代鸡胚成纤维细胞蛋白质提取,Chaps不可溶组分使用RIPA裂解液再次提取,RIPA不可溶组分再使用sample buffer提取,在五次采样(见下图)中,在Chaps不可溶组分和RIPA不可溶组分中都发现了大量的整联蛋白[5]。
3
caveolin-1的酪氨酸磷酸化(P-Cav-1)被发现是由p38丝裂原活化激酶和c-Src激酶的激活介导的[6]。当使用Triton-X-100和RIPA提取NIH3T3细胞时,在可溶性组分中未检测到caveolin蛋白,仅在不可溶性部分[7]和下图(RIPA 不可溶组分但SDS可溶组分)中检测到。 也就是说如果在这种情况下使用RIPA可溶性组分来检测P-Cav-1将无法被检出。

4
对于特定时间的特定样品,磷酸化和非磷酸化蛋白质的总和代表该特定蛋白质的总量。在相同的WB检测中, 磷酸化蛋白质的量增加通常伴随着非磷酸化蛋白质的降低。 如果在蛋白质提取过程中蛋白质有一部分丢失,磷酸化和非磷酸化蛋白质之间的比例则可能被改变,会导致数据偏差。 以下数据使用两种不同的蛋白质提取方法(SD-001,Invent Biotech, USA基于柱式法的蛋白质提取试剂盒与RIPA缓冲液,未公开的数据)比较p-stat-3和p-56的磷酸化模式,(G.Szanda, NIH.NIAAA / LPS,USA)。
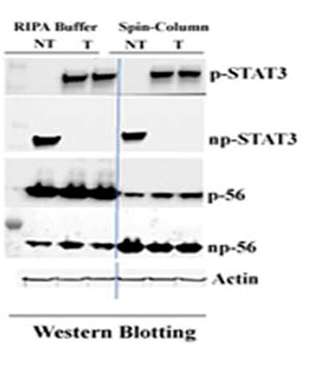
结果表明,对于stat3的磷酸化模式,处理(T)和基线水平(NT)样品使用SD-001( Invent Biotech, USA)和RIPA缓冲液无明显差异。 然而,p-56的磷酸化模式的结果却完全不同。使用SD-001的裂解物,磷酸化的p-56在化学刺激(T)后从基线水平(NT)增加,同时伴随着非磷酸化形式的降低,而RIPA缓冲液提取的样品恰恰相反。 处理的(T)样品中的磷酸化p-56小于基线水平(NT), 这个观察结果与预期不一致。 虽然确切的原因不清楚,但是蛋白丢失是导致这个结果的最大可能原因。 除了提取过程中的蛋白质损失外,还发现RIPA缓冲液人为增加激酶活性并潜在地影响蛋白磷酸化[8]。
总结,磷酸化蛋白WB做不好,很可能的原因是不适当的蛋白质提取方法影响了我们的研究。 因此,选择适当的样品制备方法对于磷酸化蛋白的成功检测和定量至关重要。Invent利用柱式法进行蛋白提取时,不产生不可溶性组分,无蛋白丢失,可以得到更准确的结果。
参考文献:
1.Li, Q. (2016) Pitfalls of protein extraction by RIPA buffer. Biotechniques. 61:327
2.Ngoka, L. CM. (2008) Sample prep for proteomics of breast cancer: proteomics and gene ontology reveal dramatic differences in protein solubilization preferences of radioimmunoprecipitation assay and urea lysis buffers. Proteome Science. 6:3
3.Brady, O. A. et al. (2011) Regulation of TDP-43 aggregation by phosphorylation and p62/SQSTM1. J. Neurochem. 116: 248-259.
4.Mukhopadhyay, C. et al. (2016).Casitas B-cell lymphoma (Cbl) proteins protect mammary epithelial cells from proteotoxincity of active c-Src accumulation. PNAS. 5: 8228-8237. 5.Haimovich, B. et al. (1991) Cellular partitioning of betta-1 integrins and their phosphorylated forms is altered after transformation by Rous sarcoma virus or treatment with cytochalasin D. Cell Regulation. 2:271-283.
6.Volonte,D. et al. (2001) Cellular stress induces the tyrosine phosphorylation ofcalveolin-1 (Tyr14) via activation of p38 mitogen-activated protein kinase andc-Src kinase. J. Biol. Chem. 276: 80948103.
7.Yan, S. R. et al. (1996) Activation of SRC family kinases in human neutrophils. Evidence that p58c-FGR and p53/56LYN redistribution to a triton X-100 insoluble cytoskeletal fraction, also enriched in the caveolar protein Caveolin, display an enhanced kinase activity. FEBS letter. 380:198-203.
8.DeSeau,V. et al. (Analysis of pp60c-src tyrosine kinase activity and phosphotyrosyl phosphatase activity in human colon carcinoma and normal human colon mucosal cells. J. Cellular Biochem. 35: 113-128.






 站内热点
站内热点