参考文献:
1. Dong, C. H., & Fu, Y. P. (2015). Isolation of plasma membrane proteins from plants. In Plant signal transduction (pp. 123-133). Springer, Cham.
2. Walter, H. (Ed.). (2012). Partitioning in aqueous two–phase system: theory, methods, uses, and applications to biotechnology. Elsevier.
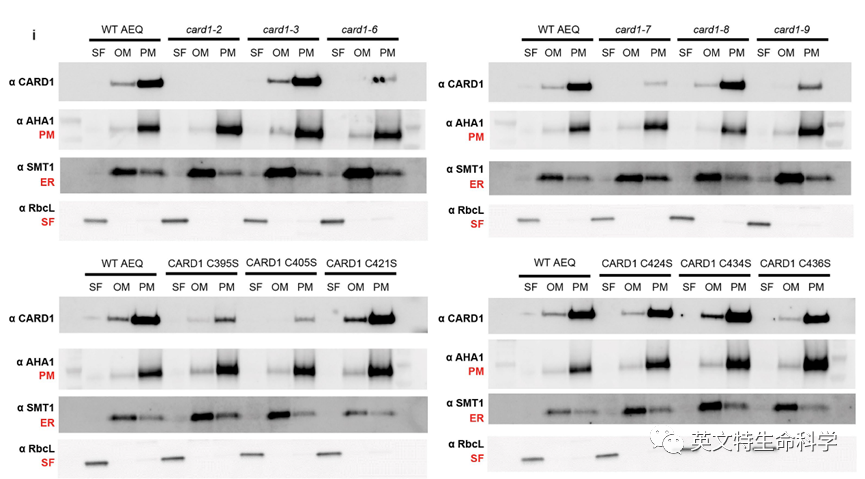
3. Brillada, C., Teh, O. K., Ditengou, F. A., Lee, C. W., Klecker, T., Saeed, B., ... & Hoehenwarter, W.(2020). Exocyst subunit Exo70B2 is linked to immune signalling and autophagy. The Plant Cell.
4. Laohavisit, A., Wakatake, T., Ishihama, N., Mulvey, H., Takizawa, K., Suzuki, T., & Shirasu, K.(2020). Quinone perception in plants via leucine-rich-repeat receptor-like kinases. Nature, 1-6.
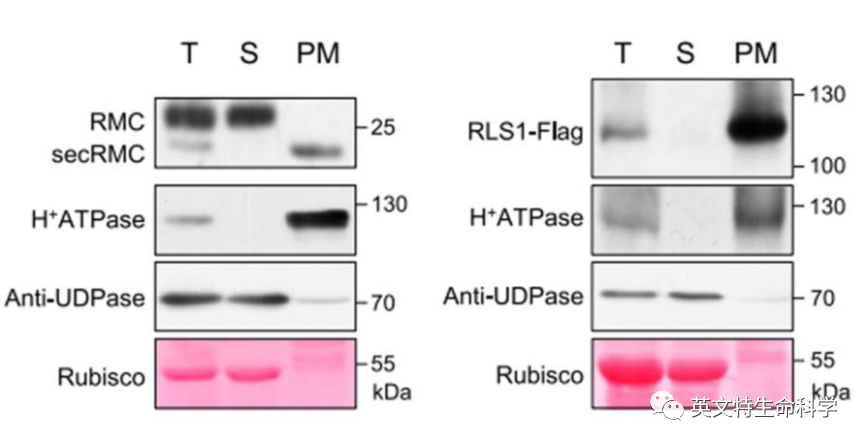
5. Wang, Y., Teng, Z., Li, H., Wang, W., Xu, F., Sun, K., ... & Tang, J. (2022). An activated form of NB-ARC protein RLS1 functions with cysteine-rich receptor-like protein RMC to trigger cell death in rice. Plant Communications, 100459.
6. Rehman, H. M., Chen, S., Zhang, S., Khalid, M., Uzair, M., Wilmarth, P. A., ... & Lam, H. M.(2022). Membrane Proteomic Profiling of Soybean Leaf and Root Tissues Uncovers Salt-Stress-Responsive Membrane Proteins. International Journal of Molecular Sciences, 23(21), 13270.
7. Wang, Q., Li, Y., Ishikawa, K., Kosami, K. I., Uno, K., Nagawa, S., ... & Kawano, Y. (2018).Resistance protein Pit interacts with the GEF OsSPK1 to activate OsRac1 and trigger rice immunity. Proceedings of the National Academy of Sciences, 115(49), E11551-E11560.
8. Wang, Q., Li, Y., Ishikawa, K., Kosami, K. I., Uno, K., Nagawa, S., ... & Kawano, Y. (2018).Resistance protein Pit interacts with the GEF OsSPK1 to activate OsRac1 and trigger rice immunity. Proceedings of the National Academy of Sciences, 115(49), E11551-E11560.
9. Ma, S., Sun, L., Sui, X., Li, Y., Chang, Y., Fan, J., & Zhang, Z. (2019). Phloem loading in cucumber:combined symplastic and apoplastic strategies. The Plant Journal, 98(3), 391-404.
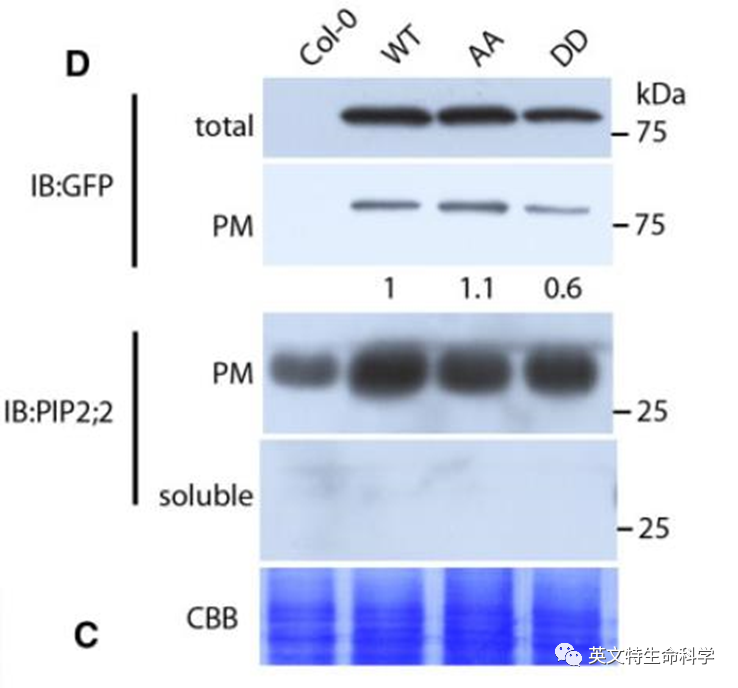
10. Zhang, S., Feng, M., Chen, W., Zhou, X., Lu, J., Wang, Y., ... & Gao, J. (2019). In rose, transcription factor PTM balances growth and drought survival via PIP2; 1 aquaporin. Nature plants, 1.
11. Zhang, S., Feng, M., Chen, W., Zhou, X., Lu, J., Wang, Y., ... & Gao, J. (2019). In rose, transcription factor PTM balances growth and drought survival via PIP2; 1 aquaporin. Nature plants, 1.
12. Chai, H., Guo, J., Zhong, Y., Hsu, C. C., Zou, C., Wang, P., ... & Shi, H. The plasma‐membrane polyamine transporter PUT3 is regulated by the Na+/H+ antiporter SOS1 and protein kinase SOS2.New Phytologist.
13. Zhu, Y., Qiu, W., Li, Y., Tan, J., Han, X., Wu, L., ... & Zhuo, R. (2021). Quantitative proteome analysis reveals changes of membrane transport proteins in Sedum plumbizincicola under cadmium stress. Chemosphere, 132302.
14. Rehman, H. M., Chen, S., Zhang, S., Khalid, M., Uzair, M., Wilmarth, P. A., ... & Lam, H. M.(2022). Membrane Proteomic Profiling of Soybean Leaf and Root Tissues Uncovers Salt-Stress-Responsive Membrane Proteins. International Journal of Molecular Sciences, 23(21), 13270.


 站内热点
站内热点