做实验的人都知道,WB是一条不归路。走上这条路的人都会情不自禁的感慨到:做WB难,做磷酸化蛋白的WB简直是难上加难!磷酸化蛋白做了上百次,能出影子的都不多,出了“影子”又符合趋势的更是寥寥无几,真是令人头秃有没有。经历了无数次失败的小编,根据实际情况总结了一些经验分享出来,希望能对大家有所启发。
磷酸化蛋白WB和常规蛋白WB其实没有真正的差异,磷酸化蛋白WB难做的主要原因是:
(1) 不同的细胞生长状况不同或处于特定的细胞周期时,磷酸化蛋白可能仅占细胞总蛋白中的一小部分,丰度低难以检测。
(2) 由于蛋白的磷酸化是可逆的,样品处理不得当时,会被快速的去磷酸化。
也就是说磷酸化蛋白WB能否成功的关键在于蛋白样品的质量!
所以,有些磷酸化蛋白WB失败,可能在第一步样品制备过程中就出错了!磷酸化蛋白样品制备需要注意如下三个问题!
实验前需先查阅文献或通过预实验检测该样本是否表达目的磷酸化蛋白,若正常情况下样本的磷酸化蛋白水平过低或不表达,可通过物理或化学方法进行一定的刺激和诱导,正确的刺激会帮助得到最佳的实验结果。
二、样品制备所用的方法是否适合于磷酸化蛋白的提取?
所有的蛋白制备方法都适用于磷酸化蛋白的提取吗?我们一起看两个案例。
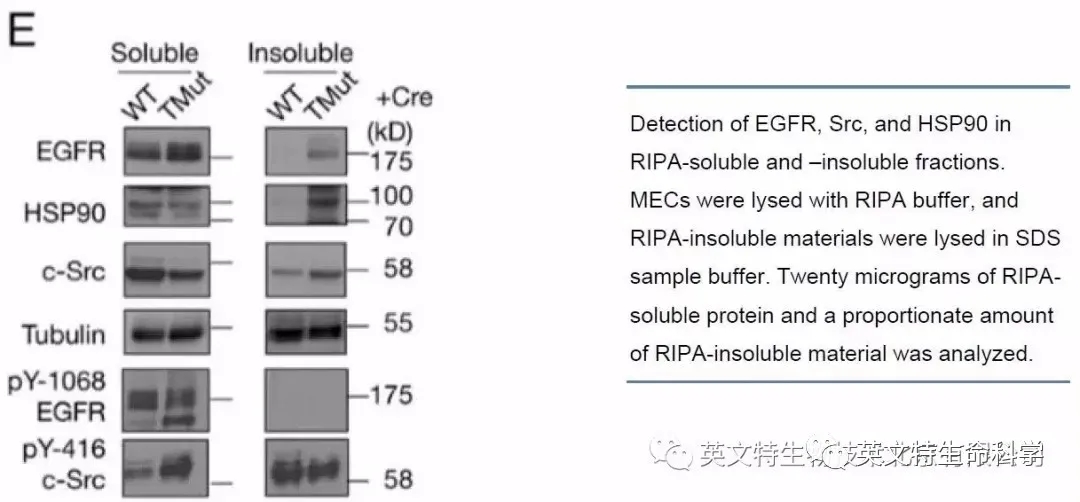
Mukhopadhyay C等人[1]使用RIPA裂解液对小鼠MEC细胞样品进行裂解,离心后将细胞裂解物分为RIPA可溶性组分(上清)和RIPA不可溶性组分(沉淀)。用WB分别检测两个组分,结果显示磷酸化的EGFR(pY-1068 EGFR)只在RIPA可溶性组分中检测出。然而,磷酸化的c-Src(pY-416 c-Src)则在RIPA可溶性和RIPA不可溶组分中都能检测出, 甚至WT样品在RIPA不可溶组分中的信号比RIPA可溶性组分中更强(如图),结果表明RIPA不可溶组分中也包含大量磷酸化蛋白,如果仅使用可溶性组分进行实验,则会导致磷酸化c-Src丢失,并产生与理论预期相反的结果,故RIPA裂解液并不适合所有磷酸化蛋白的提取!

1: 空白+ Invent 组; 2: 模型+ Invent 组; 3: 空白+ RIPA组; 4: 模型+ RIPA组
图1 两组大鼠不同蛋白提取法的PI3K/Akt /mTOR信号通路相关蛋白表达电泳图
在另一个案例中,NI Hui等人[2]研究了不同蛋白提取方法对PI3K/Akt/mTOR信号通路相关蛋白表达量的影响。空白组和模型组大鼠各3只,取双侧海马组织,每个样品分别采用RIPA裂解液法、Invent柱式蛋白提取法进行蛋白提取,分为空白+ Invent组、空白+ RIPA组、模型+Invent组、模型+ RIPA组。用WB检测PI3K/Akt /mTOR信号通路相关蛋白表达情况。
结果显示:RIPA提取法中PI3K/β-actin,p-Akt/Akt以及p-mTOR/mTOR的表达水平较Invent柱式提取法明显降低。在Invent柱式提取法中,空白组和模型组PI3K/β-actin,p-Akt/Akt以及p-mTOR/mTOR的表达水平比较差异有统计学意义( P = 0. 001) ,模型组PI3K/β-actin,p-Akt/Akt以及p-mTOR/mTOR的表达水平较空白组明显减少; 而RIPA提取法中两组PI3K/β-actin,p-Akt/Akt以及p-mTOR/mTOR的表达水平差异无统计学意义(P > 0.05)。
结果表明,大鼠海马PI3K、p-Akt /Akt、p-mTOR/mTOR 表达均受组别和提取方法的影响,组别和提取方法存在交互作用,运用Invent柱式蛋白提取法提取蛋白,模型组的PI3K、p-Akt /Akt、p-mTOR/mTOR 表达较空白组减少,差异有统计学意义( P < 0. 05) 。
根据以上结果我们可以得出以下结论: 慢性应激抑制大鼠海马PI3K/Akt /mTOR 信号通路,Invent 柱式蛋白提取法操作便捷,蛋白提取率高,尤其对信号通路中磷酸化蛋白的提取具有明显的优势。
以上两个案例说明并非所有的提取方法都适用于磷酸化蛋白的提取。例如在常用的RIPA裂解液提取蛋白的过程中,会产生RIPA可溶性组分和RIPA不可溶性组分,往往用于研究的只是前者,后者则被丢弃忽略,而最新文献报道有10%-30%的蛋白会丢失在不可溶组分中[3],因此使用RIPA裂解液提取的仅是部分可溶性蛋白,并非总蛋白。提取的蛋白有非等比例的丢失,内参也有可能存在丢失的情况。如果做磷酸化蛋白定量,磷酸化和非磷酸化蛋白质之间的比例则可能被改变,从而导致数据偏差。
和RIPA裂解液法相比, Invent柱式蛋白提取法对磷酸化蛋白的提取率较高,能较好地反映出各组原本的磷酸化蛋白的表达水平,所以选择适当的样品制备方法对于磷酸化蛋白的成功检测和定量至关重要。
由于蛋白的磷酸化是可逆的,会被磷酸酶去磷酸化,所以在样品制备和整个检测过程中,需要抑制或避免细胞内源性和外源性的磷酸酶的干扰。细胞一旦裂解,蛋白酶和磷酸酶会立即释放到细胞裂解物中。磷酸酶的周转率非常快, 磷酸化蛋白质可以在几毫秒内去磷酸化。为了防止蛋白质被降解和去磷酸化,使用前需要在细胞裂解液中加入蛋白酶和磷酸酶抑制剂。
提取过程中尽量不要用超声波细胞破碎仪来粉碎细胞,并始终保持低温环境。在测定蛋白浓度后,应尽快将样品与上样缓冲液混合煮沸,分装保存,避免反复冻融。
通过以上的经验分享,想必能更好的帮助大家找到实验失败的原因了。磷酸化蛋白因其表达丰度较低,仅占总蛋白中的小部分,且蛋白提取过程中极易降解或因处理不当迅速去磷酸化,导致磷酸化蛋白在WB检测中结果不尽人意。故蛋白样品质量至关重要,选择适当的蛋白样品制备方法,提高样品质量可以大大降低磷酸化蛋白WB的检测难度!
扫描下方二维码,可领取柱式法蛋白提取试剂盒“尝鲜券”一张

使用规则:柱式法“代金尝鲜券”100元,仅可购买Invent Minute TM系列试剂盒(4 tests)使用,使用后于2021.12.11前再次购买Minute TM系列试剂盒正装即可享受立减500元优惠。
参考文献:
1. Mukhopadhyay C,Triplett A,Bargar T,et al. Casitas B-cell lymphoma ( Cbl) proteins protect mammary epithelial cells from proteotoxicity of active c- Src accumulation[J]. Proc Natl Acad Sci U S A,2016,113( 51) : E8228 - E8237.
2. Hui N I , Zhang M , Haiqing A O , et al. Effect of Different Protein Extraction Methods on Expressions of PI3K/Akt/mTOR Signaling Pathway-related Proteins[J]. Chinese Archives of Traditional Chinese Medicine, 2019.
3. Janes KA. An analysis of critical factors for quantitative immunoblotting[J]. Science Signaling,2015,8( 371) : rs2.





 站内热点
站内热点