WB实验困难,膜蛋白WB更是难上加难,经常没有条带,偶尔能看到若隐若现的条带,已实属不易,有时虽有条带,但还是分子量不对或者条带扭曲。为什么膜蛋白WB经常会出现这样的问题呢?
PART.01原因分析
-
提取困难:膜蛋白与膜结合紧密,不易从膜上洗涤下来,特别是跨膜蛋白,具有多重跨膜结构域,提取分离困难,样品质量差导致WB失败。
-
表达量低:膜蛋白在样品中的表达量通常不高,在总蛋白中占比较低,用总蛋白检测时,目标蛋白含量可能低于WB检测下限,无法检测到。
-
易形成多聚体:膜蛋白在热变性过程中容易形成多聚体,使抗体无法识别或条带分子量发生变化或扭曲。
-
分子量大:部分膜蛋白分子量较大,大分子量蛋白WB,电泳,转膜等条件需要摸索,较为困难。
PART.02如何解决
1、了解样品与蛋白特性
样品制备是WB实验至关重要的第一步,制备方案的选择取决于使用的样品类型和蛋白特性。通过生信信息,我们可以快速了解目标膜蛋白在哪些组织中表达,是否具有特异性,是否是跨膜蛋白以及蛋白的分子量和在细胞中的分布及表达量情况。
2、选择合适的蛋白制备方案
膜蛋白WB样品制备有两种方案可选,一种为常规总蛋白制备方案,另一种为富集膜蛋白方案。
常规总蛋白制备方案:
总蛋白提取是通过对组织或细胞样品进行裂解,释放出目的蛋白。不同的裂解液配方对蛋白溶解能力有所不同。基于溶液法的提取裂解液有RIPA,NP-40,Triton X-100,SDS等。最常用的RIPA裂解液,对膜蛋白这类难溶蛋白的溶解效率低,且在离心取上清弃掉沉淀的步骤已被证实有 10-30% 的蛋白会丢失在不可溶组分中,从而影响蛋白的提取质量及完整性【1,2】,并缺少有效的杂质去除步骤,获得的蛋白纯度较低。因此并不建议使用RIPA裂解液进行膜蛋白的提取。
推荐使用升级方案,Invent柱式法总蛋白提取试剂盒(Invent Cat#SD-001/SN-002),进行无内源基线改变的总蛋白提取,柱式法采用离心管柱技术和优化的裂解液配方,蛋白提取过程不产生不可溶性的沉淀,离心管柱可有效去除核酸及碎片干扰,有效解决蛋白丢失问题的同时,提高了蛋白样品质量和纯度,可更有效的提取膜蛋白。

Fig1.柱式法SD-001裂解液与RIPA裂解液裂解效率对比图
富集膜蛋白方案:
传统富集膜蛋白采用密度梯度离心法,通过蔗糖密度梯度离心来完成膜的亚细胞结构分级分离,通常被用来富集不同的细胞器和细胞膜。但是样品需求量巨大,得率较低,需要使用超高速离心机和自配密度剂,操作时间长步骤繁琐,提取的细胞膜成分经常受到其他细胞器膜的污染,特别是线粒体、内质网、高尔基体膜等污染。为打破传统膜蛋白获取方法的局限性,推荐使用新一代膜蛋白分离技术——Invent柱式法亚细胞结构分离工具。例如Invent质膜和细胞组分分离试剂盒(Invent Cat#SM-005),利用离心管柱技术,无需超高速离心机,即可以获取具有天然活性,且与细胞器交叉污染极低的质膜结构,可用于各类下游检测。分离原理:细胞/组织通过Buffer A致敏,在16000Xg离心作用下细胞通过离心管柱(Z字形通道),细胞膜被划开使得细胞破裂,后续通过差速离心和密度离心将依次得到细胞核、胞浆、细胞器以及质膜四个组分,均可用于下游检测。
 Fig2.SM-005质膜和细胞组分分离试剂盒分离原理示意图
Fig2.SM-005质膜和细胞组分分离试剂盒分离原理示意图
 Fig3.SM-005质膜和细胞组分分离试剂盒分离结果示意图
Fig3.SM-005质膜和细胞组分分离试剂盒分离结果示意图
两种方案如何选择:
总蛋白制备方案操作简单,所需样品量低,实验成本低,在不需要进行膜蛋白定位验证相关实验的情况下,可以作为首先选择的方案,尽量选择对膜蛋白提取效率高的配方和提取方案即可。
膜蛋白样品制备方案,更适合目的蛋白丰度很低,用总蛋白无法检出的样品,需要进行膜蛋白定位或组分间表达量对比的实验。
实验初期可以两种方案同时尝试,也可以根据掌握的信息或预实验结果,从二者中选择更加合适的方案。
3、控制蛋白制样温度
普通蛋白检测通常将样品加热到 100℃进行热变性制样,但是对于膜蛋白高温煮沸并不适合,膜蛋白具有疏水性,当它们在高温下煮沸时,膜蛋白倾向于聚集并形成二聚体或多聚体,不能被抗体很好识别。此外,大的聚集体还可能直接沉淀,即使放入凝胶孔中,也可能滞留在胶孔中,从而导致随后的检测失败。因此,热变性温度对膜蛋白检测的影响极大,有经验案例表明高温煮沸样品对糖基化蛋白检出的影响比非糖基化蛋白的影响更大。

Fig4.热变性温度影响膜蛋白 WB 检测结果
所以如果样品是膜蛋白或热敏感蛋白,例如细胞质膜、线粒体、高尔基体、内质网、溶酶体以及内体等样品,加 入Loading buffer 后,建议热变性处理步骤采用37℃,孵育30分钟,或者根据样品本身情况,采用梯度温度热变性检测最佳温度后,谨慎调整热变性温度,以提高检测效率。
4、优化大分子量膜蛋白电泳与转膜条件
凝胶浓度与孔径成反比,凝胶浓度越小,孔径越大,较大分子量的蛋白质更容易通过,所以对于高分子量蛋白(HMW,分子量>150KD),电泳时使用Tris-Acetate 3-8% 凝胶是较好的选择,也可选择使用预制梯度凝胶。电泳时,可采用120-150V的高电压,在冰水浴中进行,尽量使Marker拉开足够大的距离,通常需要4小时左右。转印膜建议使用0.45um的PVDF膜。转膜液中的甲醇容易让大分子量蛋白沉淀,所以减少转膜液中的甲醇百分比(10%或更低),并添加SDS至终浓度0.1%以稳定蛋白。高分子量蛋白WB建议湿转,转膜时间可参考表1。
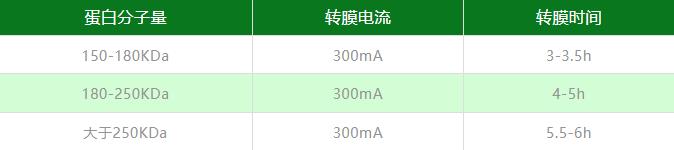
表1.转印不同分子量蛋白转膜时间表
5、合理设置对照和内参检测
对照和内参检测在WB验证中起到重要作用,务必要设置。设置阳性对照可检测WB的有效性,检测内参,可以验证蛋白上样量及样品质量是否合格。总蛋白内参可选择Actin,Tubulin,GAPDH等,膜蛋白内参可选择Na+/K+ ATPase(Invent Cat#IN-SM005AB),Pan-cadherin等。PART.03小结 膜蛋白WB检测难度高,选择合适的蛋白制备方案,提高样品中膜蛋白的含量是重中之重,控制膜蛋白热变性温度,优化大分子量膜蛋白电泳与转膜条件,合理设置对照和内参作为质控,即可获取完美的膜蛋白WB结果。
参考文献:
1.Kevin A. Janes,2017,Sci Signal. ; 8(371): rs2. doi:10.1126/scisignal.2005966.
2.Li Q,et al.(2016). Pitfalls of Protein Extraction by RIPA Buffer. BioTechniques 61:327 .doi 10.2144/000114486







 站内热点
站内热点